IPRDaidly導讀: 由美國藥企吉利德公司(Gilead Sciences, Inc.)所開發的瑞德西韋(Remdesivir),繼先前在美國第一例新型冠狀病毒肺炎病人展現其治療潛力後,2月6日已陸續於武漢中日友好醫院、金銀潭醫院等一線醫院展開臨床試驗。吉利德公司甚至表示願意免費提供試驗藥物,原本一樁美意卻因武漢病毒研究所“搶注”專利一事,引起一陣譁然。然而,吉利德公司真的就這樣吃了一記悶虧嗎?
本文針對吉利德瑞德西韋專利進行分析,並解讀吉利德公司舉動背後的意義。
根據2月4日武漢病毒研究所披露的資訊提到:
“對在我國尚未上市,且具有智慧財產權壁壘的藥物瑞德西韋(Remdesivir),我們依據國際慣例,從保護國家利益的角度出發,在1月21日申報了中國發明專利(抗2019新型冠狀病毒的用途),並將通過PCT(專利合作協定)途徑進入全球主要國家。
如果國外相關企業有意向為我國疫情防控做出貢獻,我們雙方一致同意在國家需要的情況下,暫不要求實施專利所主張的權利。”
意思是說,武漢病毒所申請專利目的是為牽制原廠專利,若吉利德公司願意不在中國行使專利權,武漢病毒所也不會行使專利權。有中企高層認為武漢病毒研究所這一做法,可讓國家免于支付藥商大筆專利藥物費用。
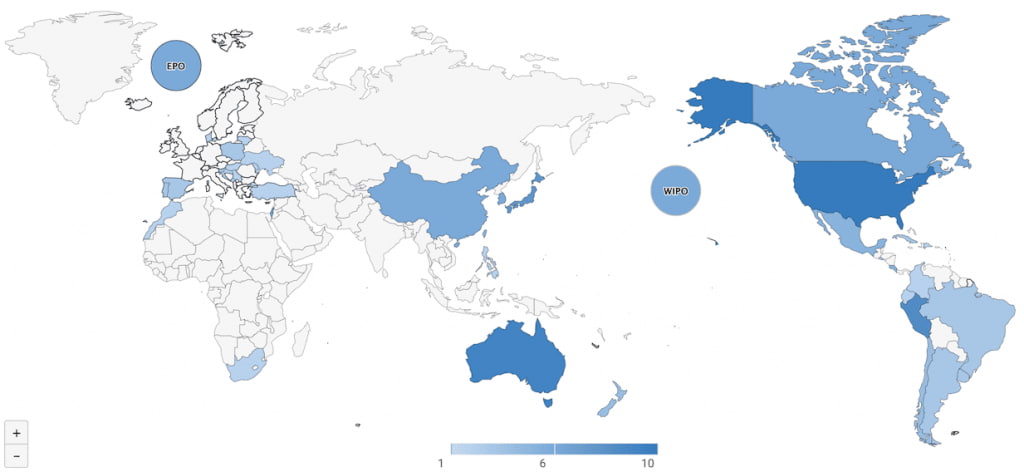
然而,吉利德從一家專注研發抗病毒藥物的公司能做到擠身全球前10大藥企,豈會是省油的燈?根據我們使用專利雲盡職調查一鍵式解決方案(Patentcloud’s Due Diligence)的分析,吉利德公司早從2011年起已陸續在全球43個國家或區域專利局申請了133個專利申請案,涵蓋範圍橫跨六大洲。
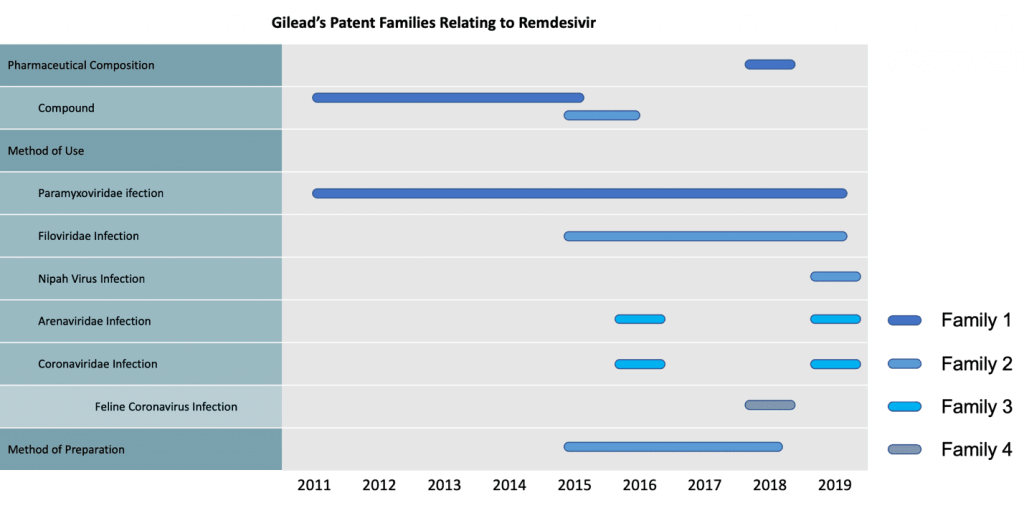
其專利申請可區分為4大專利家族,其中專利家族1及專利家族2(Family 1、Famly 2)皆涵蓋瑞德西韋相關化合物;此外,專利家族2亦涵蓋瑞德西韋化合物的製備方法。專利家族3則申請了有關治療冠狀病毒(Coronaviridae)感染之用途。
另外,吉利德也申請了有關治療副黏液病毒(Paramyxoviridae)感染用途(專利家族1)、治療絲狀病毒(Filoviridae)感染與利百病毒(Nipah Virus)感染之用途(專利家族2)、治療沙狀病毒(Arenaviridae)感染用途(專利家族3)、以及治療貓冠狀病毒(Feline Coronavirus)感染之用途(專利家族4)。
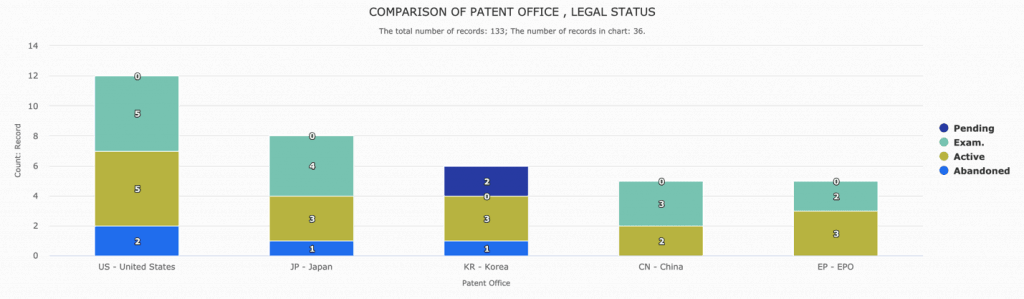
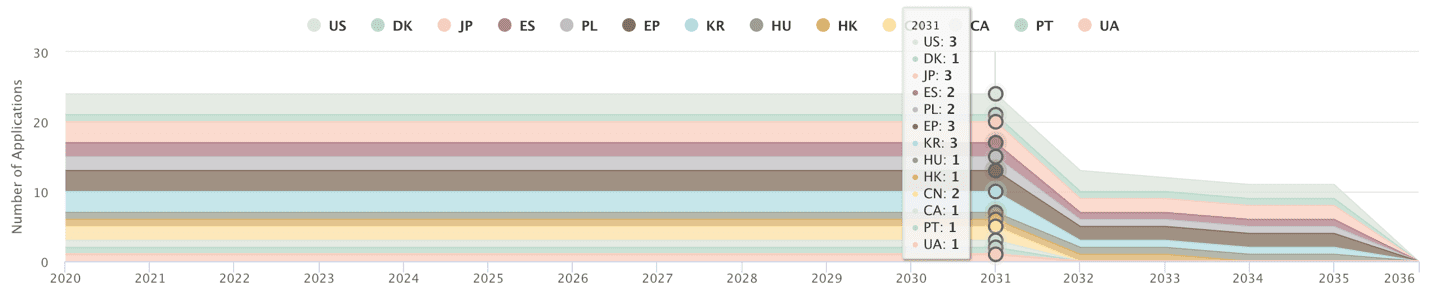
先不論武漢病毒研究所於1月21號申請的專利內容,在這麼多前案存在的情況下,要能滿足專利的新穎性及創造性要件已不容易,其PCT申請案實際要在各國取得專利權可能還要3到5年以上的時間,屆時武漢肺炎是否還存在尚不得而知,對吉利德瑞德西韋專利產品市場影響不大。然而,依專利雲盡職調查一鍵式解決方案(Patentcloud’s Due Diligence)的分析,吉利德目前在美國、中國、歐盟、日本、韓國等主要國家及區域,都已取得專利核准,其瑞德西韋化合物及製備方法相關專利權估計可持續至2031~2036年。
雖然日前吉利德CEO Daniel O‘Day于受訪時表示
“病人優先,無意捲入專利紛爭”,但他也提到“公司會保護其智慧財產權”,言下之意,現下以幫助武漢病人為其第一優先,但未來若有需要仍會主張其專利權。然而,美國藥企在商言商,提供武漢免費試驗用藥究竟有何好處?”
事實上,從專利資訊上可知,吉利德至少在2011年前就開始開發瑞德西韋相關化合物,2018年爆發剛果伊波拉病毒大流行,原本吉利德希望將瑞德西韋用來治療伊波拉病毒,但2019年顯示其在剛果的臨床試驗結果不如預期,長達9年的研發時間估計已投入了不少資源。如今碰上新冠肺炎爆發,原先失敗的產品獲得一次起死回生的機會,吉利德提供瑞德西韋專利藥物在武漢進行試驗,估計可馬上對700多位輕、重症新冠肺炎患者進行臨床試驗收案,相關單位為了解決目前肺炎燃眉之急,必定對其藥品試驗、許可等各項程式以最速件處理,倘若瑞德西韋專利藥物治療新冠肺炎確實有效,可能很快便能爭取許可上市,屆時全球對新冠肺炎唯一核准用藥的需求必然龐大,試問何樂而不為呢。

